恐惧和压抑等情绪反应是我们生活中对消极情况的正常心理和生理反应。频繁的急性情绪反应是一种病理状态,被称为慢性应激。长期的慢性应激压力会导致大脑中的各种神经变化,增加抑郁和焦虑的风险。精神疾病与免疫功能障碍密切相关,除了行为改变,慢性应激还会导致免疫代谢和心血管系统的紊乱。目前的研究已经发现了多种免疫分子在心理疾病中的生理功能。但仍不清楚外周T细胞在慢性应激诱导产生的焦虑样行为中的具体作用,例如T细胞在慢性应激诱导的行为异常中的生理功能;心理疾病中病理T细胞的特征;这种病理性T细胞通过何种机制调节中枢神经系统神经元活动。
2019年10月31日,浙江大学生命科学研究院靳津教授与东南大学生命科学与技术学院柴人杰教授共同通讯在Cell杂志发表了题为“Stress-induced metabolic disorder in peripheral CD4+ T cells leads to anxiety-like behavior”的研究论文,揭示了CD4+ T细胞嘌呤合成代谢功能紊乱与慢性应激诱导的心理疾病之间的联系。这也是东南大学首次以通讯单位在Cell上发表文章。
线粒体为细胞的生命活动提供能量,线粒体形态的变化参与了细胞代谢调控,对于细胞的正常发育维持维持至关重要。Miga2是一种线粒体外膜蛋白,敲除Miga2会导致线粒体嵴结构遭受严重破坏,失去正常情况下管状或网状的形态而呈现片段化形态。柴人杰课题组在电生理听力学检测中发现,在小鼠T细胞内特异性敲除MIGA2后,小鼠表现出听力受损的现象,对于外界多种频率声音刺激的听觉脑干诱发电位(ABR)低于普通小鼠。为了进一步了解免疫细胞中线粒体形态如何影响动物生理反应,柴人杰课题组与浙江大学靳津团队合作,利用各种动物行为学实验作为评价标准,发现体内缺少CD4+ T细胞的小鼠可以避免因外界压力下的慢性应激诱导产生心理疾病。实验数据显示,在慢性应激状态下,小鼠体内白三烯b4含量上升,使包括Naive T细胞在内的大量非炎性CD4+ T细胞线粒体碎裂。相应的代谢组学和转录组分析表明,CD4+ T细胞中线粒体碎裂可导致转录因子IRF1累积,IRF1与Ada、Xdh和Pnp2启动子区结合使葡萄糖更多的通过戊糖磷酸途径代谢,促进嘌呤从头合成。慢性应激焦虑模型中,小鼠血清黄嘌呤含量有显著的上升。柴人杰课题组从南京鼓楼医院采集到的临床证据也表明,焦虑症患者与健康对照组相比血清黄嘌呤水平升高。大脑杏仁核在恐惧与焦虑的产生中起着关键作用,T细胞产生的过量嘌呤(包括次黄嘌呤和黄嘌呤)通过血液循环进入脑部,与脑左侧杏仁核中少突胶质细胞上的腺苷受体A1结合,引起少突胶质细胞活化并增殖,继而过度活化左侧杏仁核区域神经元导致焦虑症状;同时利用脑定位注射装置向小鼠左侧杏仁核中注射腺相关病毒,特异性地敲除少突胶质细胞中的受体A1,敲除A1后焦虑小鼠症状有明显恢复,验证了以上结论。
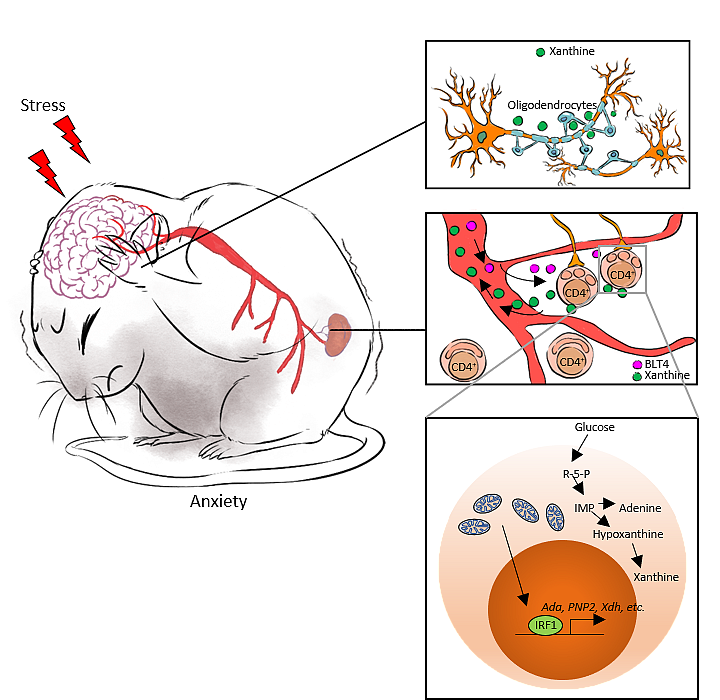
该研究成果确定了慢性应激如何影响CD4+ T细胞的线粒体形态,阐明了一种外周T细胞在慢性应激诱导产生的焦虑样行为中的具体作用。临床治疗精神疾病的大多数药物直接针对中枢神经系统,常伴随着许多副作用。加深对神经发育、精神疾病与免疫生理功能之间联系的理解,对了解抑郁症和焦虑症的发病机制并开发新的治疗药物具有重要意义。
浙江大学靳津教授与东南大学柴人杰教授为该论文的共同通讯作者。该课题得到了科技部国家重点研发计划、国家自然科学基金委优秀青年基金、中国科学院“器官重建与制造”A类战略性先导科技专项、国家自然科学基金面上项目等的资助。



