老年性聋又称年龄相关性听力损失(age-related hearing loss),是与年龄相关的听力损失累积的病理生理变化。老年性聋的发病机制复杂,目前尚无特效的治疗方法。许多研究表明,活性氧(reactive oxygen species, ROS)和线粒体结构功能异常是导致老年性聋的重要原因[1]。活性氧的过度积累会对蛋白质和DNA等生物大分子造成损害,进而引发组织和器官的退化[2]。自噬可以通过清除受损线粒体、减少氧化应激反应来抑制ROS对细胞的毒性损伤。前期研究发现,内耳毛细胞可通过激活自噬通路有效的抑制氨基糖苷药物引起的ROS上升,从而维持毛细胞在受到外界损伤时的功能和存活能力[3]。核转录因子FoxG1可通过对线粒体能量代谢及合成的调控,在细胞增殖和分化过程中发挥作用[4]。前期研究发现,FoxG1对成年小鼠毛细胞的存活至关重要[5],此外,Foxg1表达的抑制还直接导致了老化毛细胞对炎症易感性的增加[6]。因此,推测FoxG1与自噬通路之间存在联系,进而影响了毛细胞的老化进程及存活能力。
2021年5月1日,东南大学生命科学与技术学院柴人杰团队与华中科技大学附属协和医院孔维佳团队合作在自噬领域的权威期刊Autophagy(5 year IF=11.966)发表题为FOXG1 promotes aging inner ear hair cell survival through activation of the autophagy pathway的研究论文,揭示了核转录因子FoxG1与自噬信号在老年性聋发生发展过程中的协同调控作用。这是在前期关于自噬及FoxG1的数个研究(分别发表在Autophagy, Redox Biology,Neuropharmacology)基础上的新发现,详细阐述了FoxG1在毛细胞老化过程中的作用及与自噬信号间的联系。

贺祖宏等研究人员首先利用D-半乳糖构建了拟老化动物模型和细胞模型,发现在拟老化动物耳蜗及OC-1细胞中FoxG1的表达和自噬信号均出现下降,在体外实验中发现下调FoxG1直接导致细胞中自噬信号被抑制,细胞的ROS和凋亡水平也随之升高,说明FoxG1可直接通过对自噬通路的调控影响毛细胞老化进程。

另外,该研究还发现低浓度Aspirin刺激时毛细胞中FoxG1及自噬水平均出现上升,这说明低浓度Aspirin能通过激活FoxG1/自噬通路促进线粒体更新及维持细胞存活。但当抑制FoxG1表达时, Aspirin对毛细胞的保护作用则明显减弱。
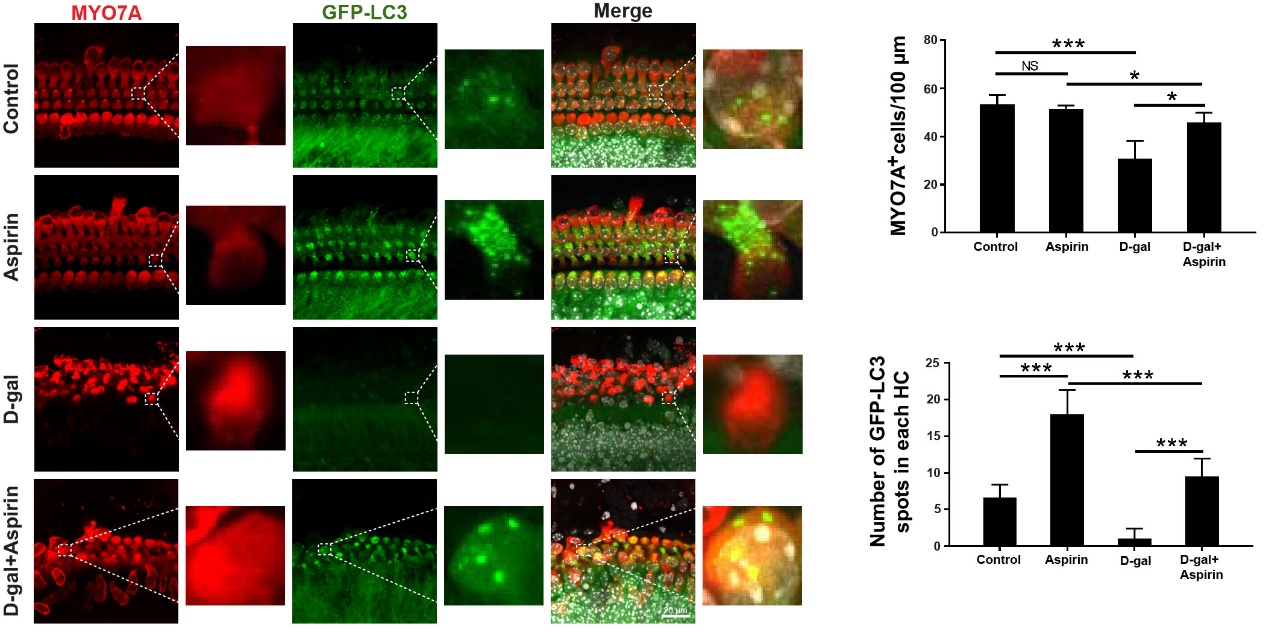
该研究证明在听觉系统退行性变过程中,毛细胞可通过激活以FoxG1和自噬信号为主的内在保护机制,促进其在老化进程中的存活能力。该研究有助于老年性聋相关分子机制的阐明,同时也为老年性聋的临床防治提供了新的靶点。

东南大学生命科学技术学院柴人杰教授和华中科技大学同济医学院附属协和医院孔维佳教授为该文章共同通讯作者,柴人杰教授博士生贺祖宏,方巧军为共同第一作者。
1.Someya, S. and T.A. Prolla, Mitochondrial oxidative damage and apoptosis in age-related hearing loss. Mechanisms of Ageing & Development, 2010. 131(7): p. 480-486.
2.Harman, D., Aging: a theory based on free radical and radiation chemistry. Journal of Gerontology, 1956. 11(3): p. 298.
3.He, Z., L. Guo, Y. Shu, Q. Fang, H. Zhou, Y. Liu, D. Liu, L. Lu, X. Zhang, X. Ding, D. Liu, M. Tang, W. Kong, S. Sha, H. Li, X. Gao, and R. Chai, Autophagy protects auditory hair cells against neomycin-induced damage. Autophagy, 2017. 13(11): p. 1884-1904.
4.Pancrazi, L., B.G. Di, L. Colombaioni, S.G. Della, G. Testa, F. Olimpico, A. Reyes, M. Zeviani, T. Pozzan, and M. Costa, Foxg1 localizes to mitochondria and coordinates cell differentiation and bioenergetics. Proceedings of the National Academy of Sciences of the United States of America, 2015. 112(45): p. 13910-5.
5.He, Z., Q. Fang, H. Li, B. Shao, Y. Zhang, Y. Zhang, X. Han, R. Guo, C. Cheng, L. Guo, L. Shi, A. Li, C. Yu, W. Kong, C. Zhao, X. Gao, and R. Chai, The role of FOXG1 in the postnatal development and survival of mouse cochlear hair cells. Neuropharmacology, 2019. 144: p. 43-57.
6.He, Z.H., S.Y. Zou, M. Li, F.L. Liao, X. Wu, H.Y. Sun, X.Y. Zhao, Y.J. Hu, D. Li, X.X. Xu, S. Chen, Y. Sun, R.J. Chai, and W.J. Kong, The nuclear transcription factor FoxG1 affects the sensitivity of mimetic aging hair cells to inflammation by regulating autophagy pathways. Redox biology, 2020. 28: p. 101364.



