作为五大感觉器官之一,耳蜗能够感知外界的声波震动,将声音信号转换为电信号传递到大脑的颞叶形成听觉。随着年龄的增长,耳蜗的生理功能逐渐退化,从而导致老年性耳聋的发生,严重影响老年人的生活质量。解析耳蜗衰老的机制是理解并干预老年性耳聋的重要基础。然而,耳蜗结构精巧且复杂,由耳蜗柯蒂氏器、基底膜、蜗轴、血管纹、螺旋韧带等不同解剖区域组成,包含数十种细胞类型,传统方法难以精确揭示耳蜗衰老过程中不同细胞类型的衰老规律及分子调控网络。
2022年11月12日,中国科学院动物研究所刘光慧课题组、东南大学柴人杰课题组、首都医科大学宣武医院王思课题组以及中国科学院动物研究所曲静课题组合作,在Protein & Cell杂志在线发表题为“Single-cell Transcriptomic Atlas of Mouse Cochlear Aging”的研究论文。该研究首次系统地绘制了小鼠耳蜗衰老的高分辨跨时序单细胞转录组图谱,揭示了增龄伴随的耳蜗功能减退的关键时间节点以及细胞分子调控机制,为发掘耳蜗衰老及相关退变的早期预警标志和潜在干预靶标提供了理论依据。


在该项研究中,研究人员分别获取了1、2、5、12、15月龄C57BL/6J小鼠的耳蜗组织,通过听力功能检测发现:随着月龄增加,C57BL/6J小鼠表现出高频听力丢失的特征,这与人类老年性耳聋的特征较为相似。进一步的组织学分析发现,耳蜗衰老的特征表现为:内毛细胞、外毛细胞、螺旋神经元和螺旋韧带区域的纤维细胞等重要细胞类型均发生了不同程度的丢失,以及衰老相关的血管纹萎缩等。为明确小鼠耳蜗衰老过程中的细胞和分子变化规律,研究人员利用高通量单细胞转录组测序技术,系统地揭示了耳蜗柯蒂氏器、基底膜、蜗轴、血管纹、螺旋韧带等区域,包括毛细胞(Hair cell, HC)、螺旋神经元(Spiral ganglion neuron, SGN)、血管纹中层细胞(Intermediate cell, IC)等在内的27种耳蜗细胞类型衰老伴随的基因表达特征。
研究发现,耳蜗细胞的转录噪音随着增龄而升高,表明衰老导致耳蜗细胞RNA表达的不稳定性增加。其中,血管纹中层细胞转录噪音的增加尤为显著。为了确定耳蜗衰老的时间规律,研究人员通过不同时间点之间的配对比较分析,鉴定了特定时间点之间的差异基因(Pairwise differentially expressed genes,PDEGs),并发现5月龄时小鼠耳蜗已经展现出细胞衰老的转录谱特征。通过分析PDEGs的数量,发现血管纹中层细胞在衰老过程中表现出较多的基因表达差异。不同于时间点之间的两两比较,多个时间节点能够识别动态差异表达基因(Dynamic differentially expressed genes,DDEGs),以高分辨率的形式研究基因表达随时间的连续变化理论上更能揭示耳蜗衰老的跨时序变化规律。因此,研究人员进一步通过构建相应算法并鉴定出包括持续上调和持续下调等6种表达模式的DDEGs基因集,其中血管纹中层细胞拥有较多的持续上调和持续下调的差异表达基因。持续上调的基因主要与未折叠蛋白反应(UPR)、细胞凋亡、以及免疫炎性反应相关,持续下调的基因主要与离子转运、细胞基质黏附等相关,提示耳蜗衰老过程中伴随着细胞损伤的累积和功能下降。
研究人员进一步聚焦于血管纹中层细胞,通过对UPR通路的详细分析,发现UPR的三个主要分支通路(包括ATF6、IRE1和PERK信号通路)的相关基因的表达均随着衰老上调。一方面,UPR下游的应激代偿通路,包括内质网分子伴侣、内质网相关蛋白降解、NRF2等通路相关基因的表达随衰老而升高。另一方面,凋亡相关基因的表达也呈现出増龄伴随的上调。这些结果提示UPR代偿通路不足以抵消增龄伴随的持续的内质网应激,无法阻止耳蜗衰老相关损伤,进而引起中层细胞的凋亡。此外,研究发现血管纹中层细胞中UPR相关基因Hsp90aa1的上调最为明显,提示其可能作为耳蜗衰老相关损伤的潜在调控因子在中层细胞衰老中发挥作用。实验表明,在小鼠血管纹细胞中敲低Hsp90aa1可加剧细胞的UPR和凋亡程度,而激活Hsp90aa1可减轻应激压力下细胞内蛋白聚集并拮抗细胞凋亡。以上研究成果提示靶向Hsp90aa1-UPR通路可能为耳蜗衰老的干预提供新思路、新策略。
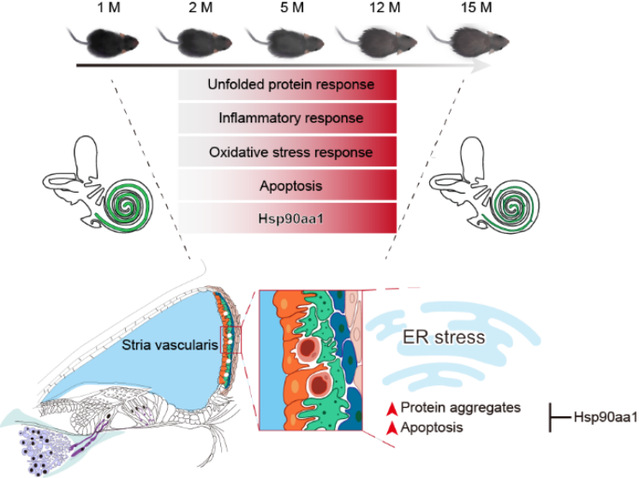
该研究首次报道了小鼠耳蜗衰老的跨多时间点的高分辨单细胞转录组景观图谱,系统地解析了耳蜗组织中多种细胞类型随衰老变化的规律,揭示了耳蜗衰老的新的分子特征。研究不仅加深了人们对耳蜗结构和功能增龄性退变的认识,阐明了耳蜗衰老过程的关键易感细胞类型及易感分子,且为评估耳蜗衰老程度及预警老年性耳聋提供了潜在的诊断生物标志物,为发展靶向耳蜗衰老的干预新策略奠定了理论基础。
中国科学院动物研究所刘光慧研究员、东南大学柴人杰教授、首都医科大学宣武医院王思研究员、中国科学院动物研究所曲静研究员为该论文共同通讯作者。中国科学院动物研究所博士研究生孙国强、郑彦东,东南大学付小龙副教授,中国科学院北京基因组研究所张维绮、任捷研究员为该论文共同第一作者。
相关数据已上传至衰老多组学数据库Aging Atlas (https://ngdc.cncb.ac.cn/aging/landscape?project=Mouse_Cochlea)。
原文链接:https://academic.oup.com/proteincell/advance-article/doi/10.1093/procel/pwac058/6823876
(转自BioArt公众号)



