细胞凋亡(apoptosis)是一种基因控制的细胞自主、有序的死亡形式,其通过清理紊乱细胞,调控生物体内在稳态,生长发育的形态建成等。细胞凋亡通路的异常调控与肿瘤的发生和靶向密切相关。细胞凋亡的分子机制研究显示,BCL2家族中促凋亡因子的表达调控可以维持细胞凋亡平衡和决定细胞命运。促凋亡因子,以PUMA,BAX等为代表,在正常状态及肿瘤细胞中通常处于极低的表达水平,转录受到抑制。促凋亡因子的激活主要受到转录因子p53的调控,然而,是否有转录因子在其中扮演“抑制者”的角色?维持促凋亡因子的低表达水平,协调细胞凋亡的内在稳态,目前还知之甚少。
2022年11月12日,东南大学生命科学与技术学院罗卓娟教授和林承棋教授团队在细胞死亡领域权威期刊Cell Death and Differentiation 杂志发表了题为“QSER1 preserves the suppressive status of the pro-apoptotic genes to prevent apoptosis” 的研究工作。报道了一个新的细胞凋亡抑制型的转录因子:QSER1,其通过维持促凋亡因子的低水平表达,抑制细胞凋亡。

在前期研究中,团队发现QSER1可以和BRCA2,ZFP281,EMSY 形成复合物,结合在基因组上阻碍R-loop异常积累,维持胚胎干细胞DNA复制的正常进程 (Nature communication. 2022)。本研究聚焦于QSER1在癌症中的表达和功能调控。通过临床数据分析显示,QSER1在多种肿瘤组织中高表达,且高水平的QSER1表达与不良的临床预后存在正相关性。进一步的功能研究发现,肿瘤细胞中QSER1的敲低显著促进了细胞凋亡(图1)。
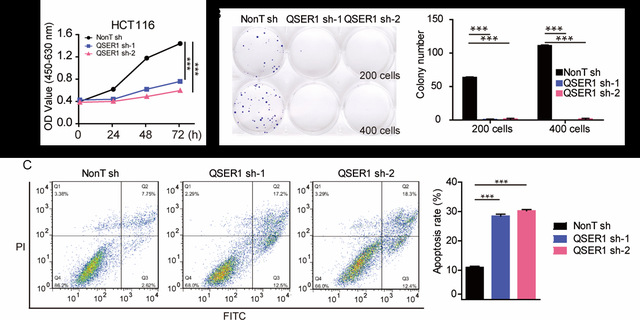
图1.敲低QSER1促进细胞凋亡
促凋亡相关基因被转录因子p53激活是细胞凋亡调控的重要步骤,p53突变是最常见的癌症突变,其功能的缺失往往导致癌细胞获得抵抗凋亡的能力。通过下游调控分析,文章发现,QSER1和p53在促凋亡基因座位分别结合在不同位置,并互相拮抗发挥转录调控功能。进一步的功能研究发现,QSER1以p53依赖和非依赖两种方式调控肿瘤细胞的凋亡。文章随后对QSER1非依赖于p53调控的机制进行了研究,QSER1在促凋亡因子PUMA基因座位结合在新的DNA调控元件QBP上。QBP的缺失会抑制PUMA并诱导细胞凋亡。分子机制上,QSER1通过招募转录抑制因子SIN3A来实现促凋亡基因的表达抑制作用。
综上所述,文章揭示了QSER1是一种具有普遍效应的抗凋亡因子,在p53存在或者突变/缺失中,都可以通过抑制促凋亡基因转录并维持其低表达水平,进而抑制细胞凋亡(图2.作用模式图)。提示靶向QSER1可能作为诱导多种癌症,特别是p53突变癌症细胞凋亡的普遍策略。
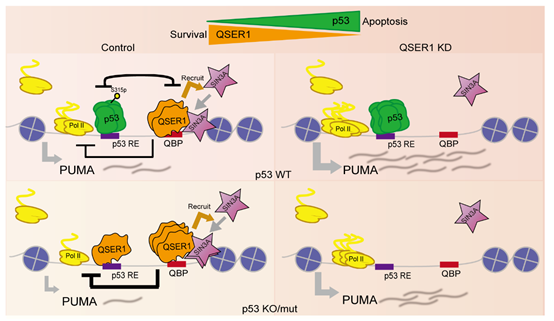
图2.作用模式图
东南大学生命科学与技术学院罗卓娟教授和林承棋教授为该论文的共同通讯作者。东南大学生命科学与技术学院博士生赵西茹、方可博士、博士生刘晓旭为该论文的共同第一作者。该工作得到了科技部国家重点研发计划 (2018YFA0800100) ;国家自然科学基金 (32030017、31970617) ;深圳市科技计划 (JCYJ20210324133602008);江苏省重症医学重点实验室(JSKLCCM-2021-01-004); 东南大学至善学者计划(2242022R40063)等项目的资助。
林承棋教授和罗卓娟教授团队长期研究干细胞命运决定、胚胎发育及肿瘤发生过程中的转录调控机理。



