先天性心脏病(CHD)是最常见的先天性畸形,源于早期胚胎期心脏发育过程中出现的结构或功能异常。深入理解其中的分子机制和发育过程,对于改进CHD的诊断、治疗和预防策略至关重要。心脏发育依赖于精密的时空调控机制,然而,关于心脏祖细胞的空间起源与时空动态调控过程,依旧存在诸多未解之谜。
2025年6月10日,生命科学与技术学院林承棋/罗卓娟教授与生物科学与医学工程学院谢芃研究员团队联合多家研究机构在Genome Biology杂志上发表题为Integration of single-cell and spatial transcriptomics by SEU-TCA reveals the spatial origin of early cardiac progenitors的研究论文,提出一种新型的空间转录组整合分析工具——SEU-TCA(Spatial Expression Utility - Transfer Component Analysis),解析了心脏祖细胞的“空间信息编码”,并系统揭示了第二心场心脏前体细胞空间亚型。

心脏祖细胞的命运决定过程与其精确的空间定位密切相关,然而,传统方法无法实现单细胞精度的空间信息解析,难以准确定义前体细胞亚型及其空间分布。为破解这一难题,研究团队提出了一种基于转移成分分析(TCA)的整合策略SEU-TCA,通过单细胞RNA测序(scRNA-seq)和空间转录组(ST)数据联合分析,实现了单细胞精准空间映射。团队使用来自不同技术平台的多种生物样本(小鼠原肠胚、人类心脏、小鼠嗅球、人类胰腺导管癌),系统评估了SEU-TCA的性能并对比其他算法,证明了SEU-TCA优异的空间解卷积与单细胞定位能力。特别是在小鼠E7.5胚胎的scRNA-seq数据与空间图谱整合中,SEU-TCA成功建立了基因表达水平与空间位置的关联,进而揭示了多种空间特异性的中胚层细胞亚型。
通过SEU-TCA与调控子(regulon)活性的联合分析,团队系统揭示了第二心场心脏前体细胞空间亚型,识别出Irx家族转录因子在前端第二心区(aSHF)祖细胞c2亚群中的特异性表达与调控活性,提出IRX1可能为该亚群的关键调控因子。通过遗传谱系追踪证实,IRX1阳性细胞参与构建流出道(OFT)和右心室(RV),进而利用条件敲除技术,发现Irx1在心脏祖细胞中的缺失会导致室间隔缺损(VSDs)。该发现为理解先天性心脏病的分子基础提供了新的理论依据。
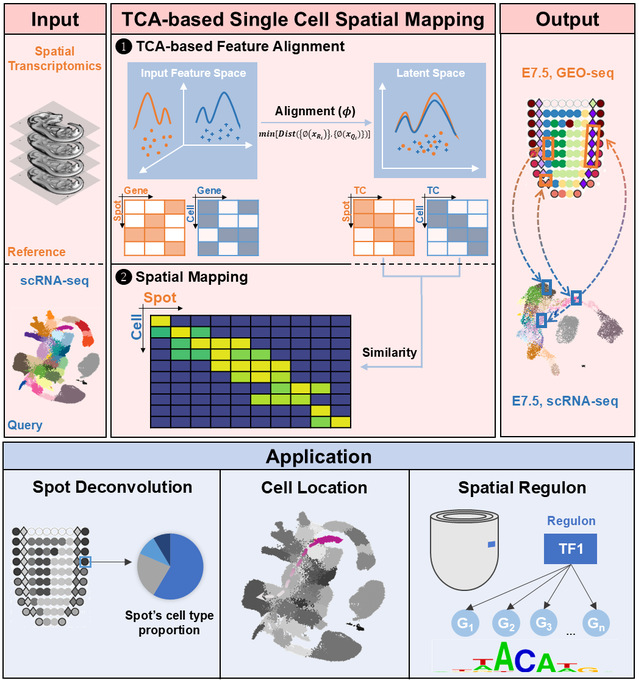
本研究提供了一项高效整合空间组学与单细胞组学数据的新方法,首次揭示了一种由IRX1调控的心脏祖细胞亚型,为先天性心脏病诊断提供了新靶点。SEU-TCA的广泛适用性和优异预测精度将助力器官发育、组织再生、肿瘤空间异质性等领域的深入研究。
东南大学生命科学与技术学院博士生何晶晶、杨屹副教授,同济大学博士生姜睿,东南大学生命科学与技术学院博士生郑彦莹为该论文的共同第一作者。东南大学生命科学与技术学院林承棋教授、生物科学与医学工程学院谢芃研究员,同济大学魏珂教授,东南大学生命科学与技术学院罗卓娟教授,东南大学中大医院曹海龙主任医师为该论文的共同通讯作者。南京大学杨中州教授、广州实验室景乃禾教授和杨贤法副研究员共同参与了本项研究。本项工作受到科技部重点研发项目的资助。
论文链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-025-03633-3



